
Práctica 3. Cálculo del equivalente en agua de un calorímetro y del calor específico de un líquido.
- 1 | Introducción y fundamento teórico

- 2 | Objetivos, materiales y realización
- 3 | Resultados, discusión y cuestiones
El objetivo de esta práctica es la familiarización del alumno con algunas leyes básicas de la termodinámica, con el concepto de equivalente en agua de un calorímetro y el cálculo del calor específico de una substancia problema.
3.1. Fundamento teórico
Supongamos que se transfiere una pequeñaa cantidad de calor 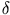 Q entre un sistema de masa m y su entorno. Si esa transferencia de
calor hace que el sistema experimente una variación de
temperatura dT, se define el calor específico (también
llamado capacidad calorífica específica) del sistema, c,
como
Q entre un sistema de masa m y su entorno. Si esa transferencia de
calor hace que el sistema experimente una variación de
temperatura dT, se define el calor específico (también
llamado capacidad calorífica específica) del sistema, c,
como

Por tanto la cantidad de calor necesaria para aumentar en dT la temperatura de una masa m de nuestro sistema es

Las unidades más usuales empleadas en el cálculo de calores específicos son J/gK y cal/gK. Para pasar de una a la otra basta recordar que 1cal=4.18J. También se usa frecuentemente el calor específico molar (o capacidad calorífica molar) C=Mc, donde M es el peso molecular de la sustancia que estemos estudiando.
Si el calor específico de una substancia es constante en el intervalo comprendido entre las temperaturas T1 y T2 entonces se deduce de la fórmula (3.2) que la cantidad de calor necesaria para llevar un cuerpo de masa m de la temperatura T1 a la temperatura T2 es
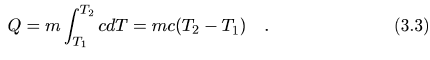
Si T2 es menor que T1, Q es negativo indicando que el sistema libera calor para de este modo disminuir su temperatura1.
NOTAAAAAAAEste criterio de signos es el llamado {\it criterio físico}, contrario al {\itcriterio químico}.}.
La realización de medidas precisas de calores específicos resulta difícil desde un punto de vista experimental pues es casi imposible evitar transferencias de calor no deseadas entre la muestra y su entorno.
Las experiencias calorimétricas se llevan a cabo en calorímetros. Estos interfieren con su propia capacidad calorífica en el experimento, por lo que ha de tenerse en cuenta su comportamiento térmico a la hora de realizar los cálculos.
Se define el equivalente en agua de un calorímetro, A, como la masa de A gramos de agua que absorbería (o cedería) la misma cantidad de calor que el calorímetro para una misma variación de temperatura.
El cálculo del equivalente en agua de un calorímetro es lo mismo que
conocer su capacidad calorífica, que tendrá que tenerse en cuenta cuando
tratemos de usar el calorímetro para determinar el calor específico de alguna
substancia.
Las medidas en los calorímetros se llevaran a cabo suministrando energía a traves del calor que se disipa en una resistencia por efecto Joule al líquido que se encuentre en su interior. La energía que se suministra por una corriente eléctrica de intensidad I, a una resistencia R (con una diferencia de potencial V en sus extremos) durante un tiempo t
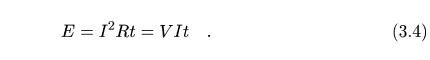
Si esta energía se suministra directamente, en forma de calor, a una masa m de una sustancia de calor específico c que se encuentra a una temperatura T en el interior del calorímetro, la temperatura se elevará hasta T´ cumpliéndose
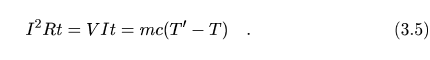
3.1.1. Cálculo del equivalente en agua del calorímetro
Para el cálculo del equivalente en agua la sustancia que usamos es agua, con calor específico ca=1cal/gK. En este caso si añadimos una masa m0 de agua al calorímetro y reescribimos la ecuación (3.5) teniendo en cuenta la influencia del calorímetro, llamando T0 a la temperatura inicial y T a la temperatura tras un tiempo t, obtenemos
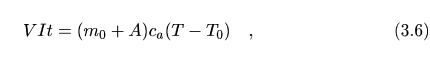
donde despejando T nos queda
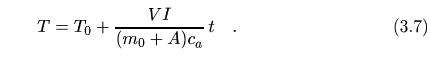
La dependencia de la temperatura T frente a tiempo t
es lineal,luego si medimos la temperatura en diferentes intervalos de tiempo podemos obtener con los datos
experimentales la recta de mejor ajuste, y del valor de la pendiente
![]() de la misma obtener el equivalente
en agua del calorímetro A.
de la misma obtener el equivalente
en agua del calorímetro A.
3.1.2 Cálculo del calor específico de una sustancia problema
Si queremos medir el calor específico cp de una sustancia problema podemos escribir la ecuación (3.5), teniendo en cuenta el equivalente en agua A, como

donde mp es la masa de sustancia problema en el calorímetro. De nuevo la dependencia de T frente al tiempo t es lineal y, con los resultados de la recta de regresión, puede calcularse la capacidad cp.








